En collaboration avec des chercheurs de l’Institut de Biologie Intégrative de la Cellule, du synchrotron SOLEIL et de l’Université de Californie à Riverside, une équipe du Laboratoire de Physique des Solides a mis en lumière le processus d’auto-assemblage de la capside du virus de l’hépatite B en présence de deux types d’antiviraux. Ils ont montré que la déformation de la capside normalement icosaédrique, vers des morphologies ellipsoïdales voire aberrantes est due à l’altération des énergies d’interaction et de courbure induite par les antiviraux.
Plus de 292 millions d’individus sont infectés chroniquement par le virus de l’hépatite B (VHB), principalement en Afrique et en Asie du Sud, faute de vaccination systématique. VHB est à l’origine de pathologies sévères telles que la cirrhose du foie ou le carcinome hépatocellulaire conduisant parfois à la mort de presque un million de patients. VHB est un virus enveloppé constitué d’une coque protéique – la capside – arrangée en une structure de symétrie icosaédrique protégeant le génome sous forme d’ADN. Durant un cycle de vie, la capside s’auto-assemble à l’intérieur de la cellule hôte. Des molécules antivirales, dénommées modulateurs d’assemblage, ont été développées pour cibler les protéines de la capside et perturber le processus d’auto-assemblage. Toutefois, les chemins cinétiques et les mécanismes physique d’action de ces modulateurs n’ont jusqu’à présent pas été explorés.
En utilisant la diffusion des rayons aux petits angles résolue en temps au synchrotron SOLEIL, nous avons mis en évidence l’accélération de la cinétique d’auto-assemblage de la capside induite par la présence de modulateurs. A l’aide d’un modèle de relaxation de transition de phase, nous avons estimé que l’énergie d’interaction effective entre les protéines variait de 9 kBT – kBT étant l’énergie thermique – en l’absence de modulateur, à plus de 18 kBT en sur-stœchiométrie de modulateur. Cela induit une augmentation de l’énergie d’étirement de la capside et se traduit par une variation profonde de la morphologie. Alors que la capside native est icosaédrique et comporte 240 protéines, nos observations en cryomicroscopie électronique à transmission ont révélé des capsides soit légèrement allongées, soit aberrantes avec une taille deux fois plus grande. Le paramètre important s’est avéré être le nombre de Föppl-von Kármán, c’est à dire le rapport entre l’énergie d’étirement et l’énergie de courbure, qui, au travers de simulations Monte Carlo à gros grains, a permis de reproduire les morphologies observées (Figure). Ces travaux fournissent un nouvel éclairage sur l’action de molécules antivirales, qui pourraient être mis à profit pour moduler la morphologie de nanocapsules biomimétiques dérivées de capsides virales.
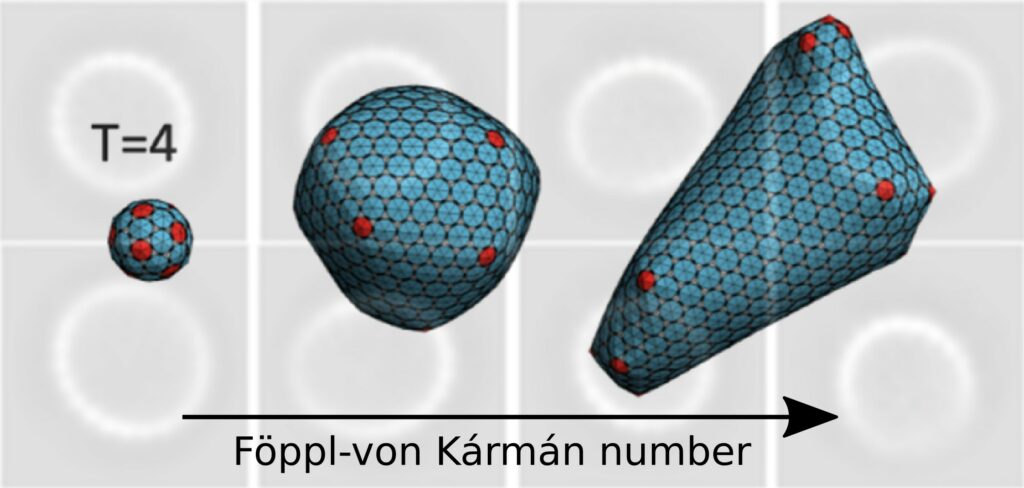
Figure. Simulations Monte Carlo illustrant le changement de morphologie d’une capside en altérant ses propriétés élastiques via le nombre de Föppl-von Kármán. L’image du fond montre des moyennes par classe de capsides en présence de modulateurs observées par cryomicroscopie électronique à transmission.
Référence
Energetics and Kinetic Assembly Pathways of Hepatitis B Virus Capsids in the Presence of Antivirals
K. Kra, S. Li, L. Gargowitsch, J. Degrouard, J. Pérez, R. Zandi, S. Bressanelli, G. Tresset,
ACS Nano, 2023, 17, 12723-12733
doi: 10.1021/acsnano.3c03595
Pour en savoir plus
Retrouvez l’actualité complète sur le site du synchrotron SOLEIL
Cette actualité a fait l’objet d’un fait marquant au près de l’Institut de Physique (CNRS)
Contact
Guillaume Tresset
